Τα παρακάτω απλά σκίτσα δείχνουν την πυκνότητα των ηλεκτρονίων για τους πρώτους τρεις φλοιούς (στιβάδες) του ατόμου του υδρογόνου. Μπορούν έτσι να δώσουν μια εντύπωση για τους περιορισμούς που διέπουν την κατασκευή του περιοδικού πίνακα . Τα όρια για τον αριθμό ηλεκτρονίων που βρίσκονται στις υποστιβάδες προκύπτουν από τους κβαντικούς αριθμούς και τη σχέση την μεταξύ τους. Αυτά τα σκίτσα προέρχονται από τις κυματοσυναρτήσεις του υδρογόνου που χαρτογραφούν την πυκνότητα των ηλεκτρονίων.

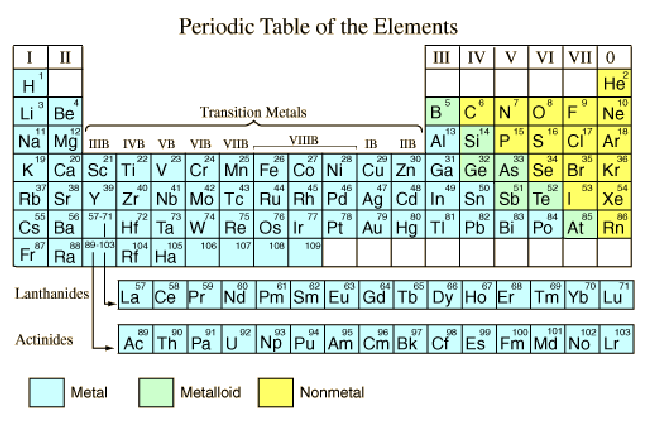
Οι αριθμοί των κύριων στοιβάδων, όπως το 1s, προκύπτουν από τον κύριο κβαντικό αριθμό n στην κβαντομηχανική περιγραφή των ηλεκτρονίων. Τα γράμματα (s, p, d, f, g, h) υποδηλώνουν τις υποστιβάδες και ακολουθούν την ιστορική κλασσική περιγραφή με τα γράμματα.
 Σε γενικές γραμμές, οι ανώτερες στιβάδες (φλοιοί) έχουν υψηλότερη ενέργεια (λιγότερο στενά δεσμευμένα στο άτομο) και είναι κατά μέσο όρο πιο μακριά από τον πυρήνα. Αυτό ισχύει αυστηρά για το άτομο υδρογόνου, όπου τα επίπεδα ενέργειας εξαρτώνται μόνο από τον κύριο κβαντικό αριθμό (η λεπτοδομή παραμελείται). Αλλά σε μεγαλύτερα άτομα, η ενέργεια εξαρτάται και από τον κβαντικό αριθμό τροχιάς l έτσι ώστε οι υποστιβάδες να γεμίζονται με τη σειρά s, p, d, f, κλπ. Αυτό το γέμισμα τελικά οδηγεί σε αλληλεπικάλυψη, με την υποστιβάδα 4s να είναι χαμηλότερης ενέργειας από την 3d υποστιβάδα.
Σε γενικές γραμμές, οι ανώτερες στιβάδες (φλοιοί) έχουν υψηλότερη ενέργεια (λιγότερο στενά δεσμευμένα στο άτομο) και είναι κατά μέσο όρο πιο μακριά από τον πυρήνα. Αυτό ισχύει αυστηρά για το άτομο υδρογόνου, όπου τα επίπεδα ενέργειας εξαρτώνται μόνο από τον κύριο κβαντικό αριθμό (η λεπτοδομή παραμελείται). Αλλά σε μεγαλύτερα άτομα, η ενέργεια εξαρτάται και από τον κβαντικό αριθμό τροχιάς l έτσι ώστε οι υποστιβάδες να γεμίζονται με τη σειρά s, p, d, f, κλπ. Αυτό το γέμισμα τελικά οδηγεί σε αλληλεπικάλυψη, με την υποστιβάδα 4s να είναι χαμηλότερης ενέργειας από την 3d υποστιβάδα.
Ο διαχωρισμός σε κύριες στιβάδες ενθαρρύνει ένα είδος «πλανητικού μοντέλου» για τα ηλεκτρόνια και ενώ αυτό δεν είναι καθόλου ακριβές ως περιγραφή των ηλεκτρονίων, έχει μια ορισμένη μνημονική αξία για την παρακολούθηση της συσσώρευσης ηλεκτρονίων των βαρύτερων στοιχείων.
Ίσως ένας καλύτερος τρόπος για να παρακολουθείτε τη διαδικασία συσσώρευσης (συμπλήρωσης με ηλεκτρόνια) είναι να παρακολουθείτε απλώς την πλήρωση των καταστάσεων με τη βοήθεια κανόνων. Όπως ότι οι καταστάσεις είναι καθορισμένες, κβαντοποιημένες, καταστάσεις ενέργειας. Η απαγορευτική αρχή του Pauli περιορίζει στενά όλη τη διαδικασία συσσώρευσης (συμπλήρωσης), επιτρέποντας σε ένα μόνο ηλεκτρόνιο να καταλαμβάνει κάθε διαθέσιμη κατάσταση. Καθώς όλη η φύση τείνει στη χαμηλότερη ενεργειακή κατάσταση, πρώτα θα γεμίσουν οι καταστάσεις με τη χαμηλότερη ενέργεια και μετά με την υψηλότερη ενέργεια.
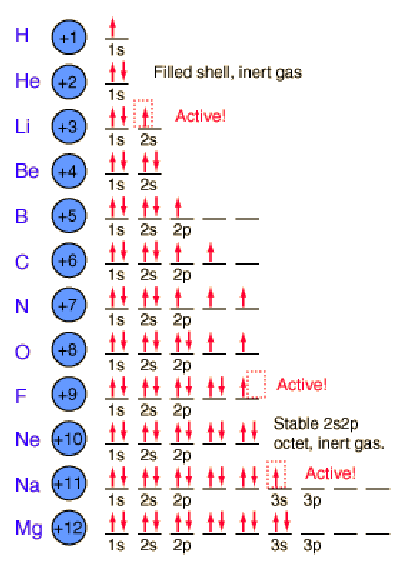
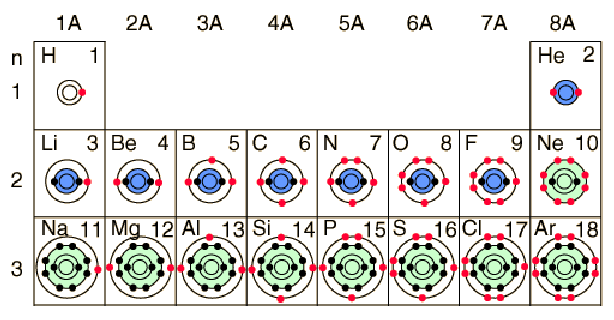
Η διαδικασία συμπλήρωσης για τα πρώτα 12 στοιχεία του περιοδικού πίνακα δίνει μερικές συμβουλές για την προέλευση της χημικής δραστικότητας των στοιχείων.Η χωρική κατάσταση του 1s μπορεί να έχει δύο καταστάσεις spin, τις οποίες συνήθως αναφερόμαστε ως “spin up” και “spin down”. Με δύο ηλεκτρόνια στην κατάσταση 1s, είναι γεμάτο και σταθερό, σχηματίζοντας το ευγενές αέριο ήλιο, το οποίο είναι χημικά αδρανές.
Το λίθιο είναι ένα πολύ ενεργό αλκαλικό μέταλλο , έχοντας μόνο ένα ηλεκτρόνιο στην δεύτερη στιβάδα. Έχει την τάση να χάνει εκείνο το 3ο μονήρες ηλεκτρόνιο για να επανέλθει στην σταθερή δομή του ηλίου.
Τα στοιχεία από το βόριο έως το νέον στον περιοδικό πίνακα πληρούν τα 2p τροχιακά. Οι τρεις δυνατότητες για τροχιακά 2p μπορούν να συσχετιστούν με χωρικές διευθύνσεις, π.χ. x, y και z. Η σειρά της συμπλήρωσης θα τοποθετήσει ένα ηλεκτρόνιο σε κάθε ένα (x,y,z) πριν τοποθετήσει δύο σε οποιοδήποτε τροχιά, αφού τα ηλεκτρόνια απωθούνται μεταξύ τους και προτιμούν να είναι απομακρυσμένα περισσότερο.
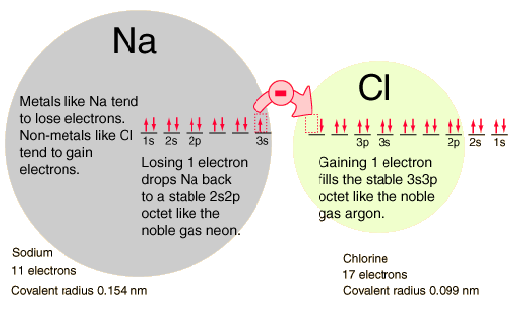
Η πλήρωση του τροχιακού 2ρ τοποθετεί οκτώ ηλεκτρόνια στο δεύτερο φλοιό – στιβάδα, μία “σταθερή οκτάδα”. Η ιδιαίτερη σταθερή διαμόρφωση παράγει το ευγενές αέριο νέον. Αλλά το φθόριο με ένα λιγότερο ηλεκτρόνιο από την σταθερή οκτάδα είναι πολύ ενεργό ! Τείνει να αποκτήσει έτσι ένα ηλεκτρόνιο, ενώ το πολύ ενεργό νάτριο τείνει να χάσει ένα ηλεκτρόνιο, παράγοντας σε κάθε περίπτωση την σταθερή διάταξη οκτάδας του νέον.
Οι διαμορφώσεις των τροχιακών παρέχουν μια δομή για την κατανόηση των χημικών αντιδράσεων, οι οποίες καθοδηγούνται από την αρχή της εύρεσης της χαμηλότερης ενεργειακής (κατάστασης) (πιο σταθερής) διάταξης των ηλεκτρονίων. Λέμε ότι το νάτριο έχει σθένος +1 επειδή τείνει να χάσει ένα ηλεκτρόνιο και το χλώριο έχει ένα σθένος -1 δεδομένου ότι έχει την τάση να αποκτά ένα ηλεκτρόνιο. Και τα δύο αυτά άτομα είναι πολύ ενεργά χημικά και ο συνδυασμός τους είναι η κλασική περίπτωση ενός ιοντικού δεσμού .
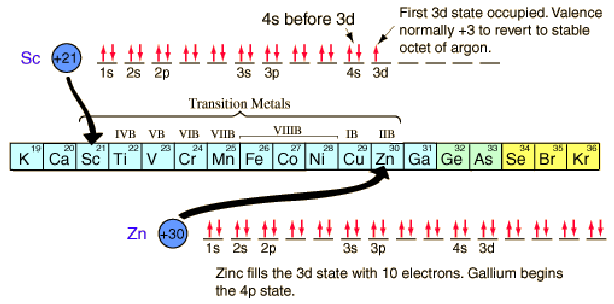
Οι χημικές ενώσεις που περιλαμβάνουν στοιχεία στις πρώτες τρεις σειρές του περιοδικού πίνακα μπορούν να γίνουν κατανοητές με το είδος των τροχιακών ιδιοτήτων που αναφέραμε παραπάνω. Τα πράγματα γίνονται πιο περίπλοκα στην τέταρτη σειρά του περιοδικού πίνακα. Τα ηλεκτρόνια του 4s βυθίζονται κάτω από τα 3d ηλεκτρόνια σε ενέργεια και αφού υπάρχουν δέκα συνδυασμοί κβαντικού αριθμού στην υποστιβάδα d, το γεγονός αυτό εισάγει 10 στοιχεία μεταξύ των υποστιβάδων 4s και 4p, τα λεγόμενα ” μεταβατικά στοιχεία “.
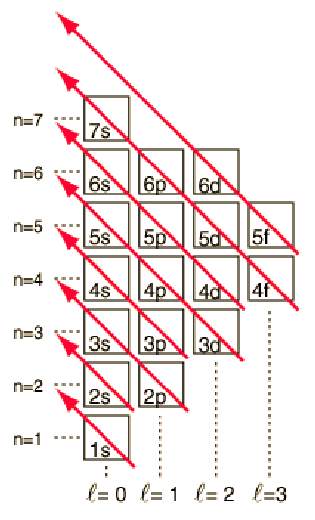
Με το μοντέλο – πρότυπο που καθορίστηκε παραπάνω, η σειρά συμπλήρωσης των επιπέδων ενέργειας των ηλεκτρονίων μπορεί να προβλεφθεί στις περισσότερες περιπτώσεις. Παρόλο που υπάρχουν ελάχιστες εξαιρέσεις, η διαβάθμιση των επιπέδων ακολουθεί το παρακάτω σχήμα που υποδεικνύεται στο διάγραμμα, με τα βέλη να δείχνουν τα σημεία στα οποία μετακινείται στον επόμενο φλοιό, αντί να προχωρήσουμε σε υψηλότερο τροχιακό κβαντικό αριθμό στον ίδιο φλοιό (στιβάδα).
 Η πρώτη εξαίρεση στο παραπάνω σχήμα που συναντάται είναι το χρώμιο, όπου κατ’ εξαίρεση καταλαμβάνεται η πέμπτη 3d κατάσταση των ηλεκτρονίων αντί της δεύτερης κατάστασης των 4s. Ο χαλκός είναι επίσης μια εξαίρεση, όπου γεμίζονται τα δέκα 3d ενώ η δεύτερη κατάσταση των 4s να είναι κενή. Αυτή η εξαιρετική συμπεριφορά χρωμίου και χαλκού εκτίθεται επίσης και από τα στοιχεία ακριβώς κάτω από αυτά στον περιοδικό πίνακα, το μολυβδαίνιο και τον άργυρο.
Η πρώτη εξαίρεση στο παραπάνω σχήμα που συναντάται είναι το χρώμιο, όπου κατ’ εξαίρεση καταλαμβάνεται η πέμπτη 3d κατάσταση των ηλεκτρονίων αντί της δεύτερης κατάστασης των 4s. Ο χαλκός είναι επίσης μια εξαίρεση, όπου γεμίζονται τα δέκα 3d ενώ η δεύτερη κατάσταση των 4s να είναι κενή. Αυτή η εξαιρετική συμπεριφορά χρωμίου και χαλκού εκτίθεται επίσης και από τα στοιχεία ακριβώς κάτω από αυτά στον περιοδικό πίνακα, το μολυβδαίνιο και τον άργυρο.